Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
Ley de Avogadro
Es aquella en el que las constantes son presión y temperatura, siendo el Volumen directamente proporcional al Número de moles (n).
Matemáticamente, la fórmula es:
Ley de Charles
A una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura.Matemáticamente la expresión:
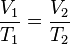 o
o 
Ley de Gay-Lussac
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 10−10 erg ·K−1·mol−1
Identificar caracteristicas de un gas, las concideraciones cineticas de los gases
En esta secuencia lo que mas se me dificulto fueel copncepto delas preguntas como la de que es un gas ideal se me dificulto pues pensar en que se referia ese consepto sin aberlo claro leeido en las copias . ya posteriormente al incurcionar en el tema pude contestar la pregunta con lo que ya avia bisto en la lectura .


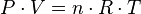
Muy buena tu manera de expresar la dificultad de la secuencia.. a mi me paso algo similar..
ResponderEliminarbuen trabajo :D